Calor
Calor é a energia que é transmitida entre corpos que se encontram em diferentes temperaturas. No Sistema Internacional, sua unidade de media é o Joule (J), mas pode-se usar também a caloria (cal).
CALORIA: uma caloria é a quantidade de energia oferecida a um grama de água para elevar sua temperatura de 14,5º C para 15,5º C.
Para conversão: 1 cal = 4,2 J.
Estados Físicos da Matéria
SÓLIDO: moléculas bem organizadas e a substância possui forma e volume bem definidos.
LÍQUIDO: a substância não possui forma definida.
GASOSO: a substância ocupa todo o volume do recipiente.
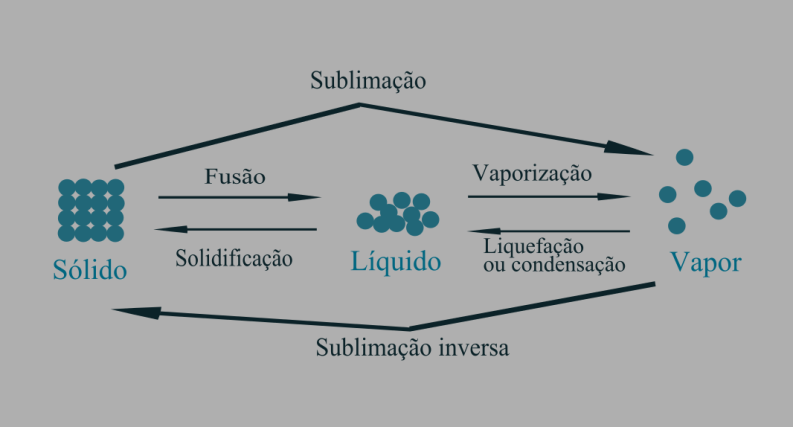

PROCESSOS ENDOTÉRMICOS: quando a substância recebe calor; refere-se a fusão, vaporização e sublimação.
PROCESSOS EXOTÉRMICOS: quando a substância perde calor; refere-se a solidificação, condensação e sublimação inversa.
É preciso lembrar que existe uma influência da pressão sobre as mudanças de fase. Isso porque a vaporização ocorre quando as moléculas do líquido possuem energia suficiente para equilibrar a pressão externa e se desprender do líquido. Assim, quanto maior for a pressão externa, maior deverá ser a energia necessária para que ocorra a vaporização de determinada substância. Além disso, o aumento na pressão ajuda a diminuir o volume da substância, dificultando na fusão da maioria das substâncias, acarretando no aumento de temperatura de suas respectivas fusões. Com o aumento da altitude, a pressão diminui, junto com o ponto de ebulição da água (diminui também).
Diagrama de Fases
É um gráfico que relaciona a pressão com a temperatura de uma substância e as curvas de equilíbrio sólido-líquido, líquido-vapor e sólido-vapor. Geralmente, o aumento de pressão acarreta no aumento da temperatura de fusão, mas com a água é diferente. Observe as imagens:
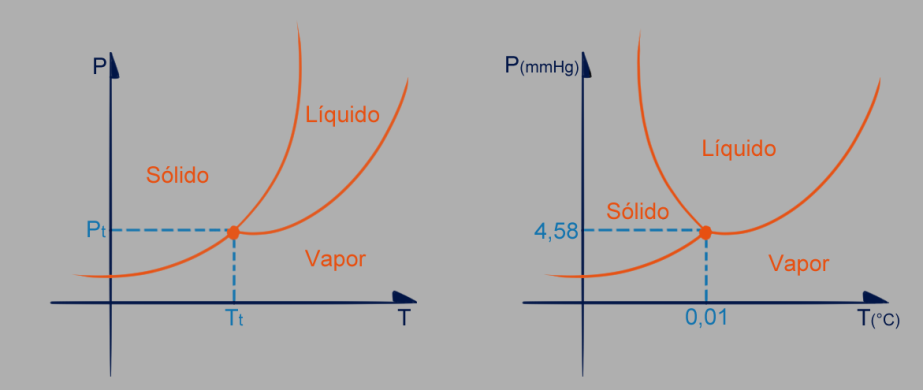

O ponto T representa o ponto triplo. Lembre-se que os valores de pressão e temperatura do ponto triplo (PT e TT) dependem da substância.
Praticando
- As cidades A e B possuem as seguintes altitudes com relação ao nível do mar: A = 3.640 m e B = 10 m. Analise as afirmações:
- A temperatura de ebulição da água é maior na cidade A.
- A temperatura de ebulição da água não depende da altitude.
- A temperatura de ebulição da água é a mesma nas duas cidades.
- A temperatura de ebulição da água é maior na cidade B.
Analisando as afirmativas, temos que:
- Falsa. A cidade A é mais alta que a cidade B, portanto sua pressão é menor, e o ponto de ebulição menor também.
- Falsa. A temperatura de ebulição varia de acordo com a altitude, pois sofre influência das diferenças de pressão.
- Falsa. A temperatura de ebulição varia de acordo com a altitude, pois sofre influência das diferenças de pressão.
- Verdadeira. A cidade B é mais baixa que a A, portanto a temperatura de ebulição da água deve ser maior.
Resumo
O estado físico de uma substância (sólido, líquido e gasoso) depende da pressão exercida sobre ela. Pode-se colocar os valores em um diagrama P x T, determinando o diagrama de fases.
